La importancia de la leishmaniasis en el
Perú radica en que constituye una endemia de tipo tropical
que produce un impacto negativo social y económico en la
población económicamente deprimida.
Además, las secuelas destructivas que ocasiona,
particularmente, la forma mucocutánea provocan el
aislamiento del individuo, por
su irreversibilidad.
HISTORIA
La leishmaniasis en el Perú
afecta ancestralmente a las poblaciones andina y selvática
de nuestro país, desde antes de la llegada de los
españoles. Un testimonio son los huacos antropomorfos
encontrados en las zonas donde se desarrollaron las culturas
Mochica (330 a.C.-500 d.C.) y Chimú (1000-1400 d.C.), que
representan secuelas destructivas y deformantes de la
leishmaniasis, como mutilaciones de los labios y de la
nariz[4].

Las primeras descripciones
clínicas de la leishmaniasis datan del siglo XVI,
época de la conquista
española. Fernando de Oviedo (1535), Pedro Pizarro (1571)
y Fernando de Santillán (1572) describen una enfermedad
que afecta a los indígenas en la ladera este de la
Cordillera de los Andes, en los valles calientes y húmedos
donde se cultiva la coca, enfermedad que destruye la nariz y las
cavidades nasales.
Las primeras descripciones de la
presencia de la leishmaniasis en nuestro país se hacen en
1586, cuando Fray Rodrigo de Loayza hacía mención
de la existencia de una enfermedad que afectaba la mucosa nasal
de indios y españoles de los Andes, y hace referencia que
la ocupación, el medio geográfico e, inclusive, la
inmunidad racial podrían estar asociados con la
enfermedad. Diego de Morales (1602), Reginaldo Lizárraga
(1605), Bartolomé de la Vega y el médico cronista
Cosme Bueno hablan de la existencia de esta enfermedad en el
Antiguo Perú[5]. Cosme Bueno, en 1764, e
Hipólito Ruiz, en 1777, identifican el rol que tienen los
flebótomos en la transmisión de la enfermedad.
Cosme Bueno, habla de una llaga corrosiva, que se llama UTA,
localizada especialmente en la cara, de difícil
curación originada por un insecto. Estas descripciones las
realizó en las zonas de Canta (Lima) y en otras provincias
frías. El médico José Julián Bravo
(1852) asemeja la UTA al botón de Alepo; le sigue la
tesis (1886)
de Minaya, Ugaz, Matto, las observaciones de Villar (1892),
Barrós (1895) y Leonidas
(1901)[6].
A finales del siglo XIX se identifica la
leishmaniasis americana en el botón de Oriente (Bravo, en
1852, y Cerqueira, en 1885). Cunningham (1885), en la India, fue el
primero en observar el microorganismo
en los mononucleares de los casos de kala-azar. Firth, en 1891,
confirmó este descubrimiento. Tamayo (1908) parece haber
sido el primero en identificar lesiones características de
UTA, denominación de la leishmaniasis cutánea
andina en las cerámicas del Perú preinca. En 1900 y
1903, Leishman y Donovan descubren, con coloración de
Giemsa, un parásito ovalado en macrófagos de
pacientes con leishmaniasis visceral. Wright (1903) describe el
primer caso de infección por Leishmania trópica;
Roger (1904) cultiva por primera vez una leishmania a partir del
bazo de un paciente con leishmaniasis visceral; Presat (1905),
por primera vez, sugiere que los flebótomos serían
los transmisores del botón de Oriente; Nicolle (1908)
cultivó L. infantum y L. trópica en el medio NNN
(Nicolle Novy MacNeal) y, posteriormente, en el medio
semisólido para leptospiras de Noguchi. Nicolle y Moncuex
(1909) inician inoculaciones experimentales en monos, perros, ratas,
pericotes y zorros, Lindenberg (1909) encontró leishmanias
en úlceras de pacientes en Sao Paulo (Brasil). Nicolle
y Sergent sugieren que el perro sería el
reservorio.
Gaspar Vianna (1910) sugiere que la
terapia con antimoniales es efectiva para el tratamiento de la
leishmaniasis en el Brasil. Splendore (1911) diagnostica la forma
mucosa de la enfermedad y obtiene cultivos positivos a partir de
lesiones mucosas. Vianna (1911) propone el nombre de Leishmania
brasiliensis para denominar al agente que produce la
leishmaniasis tegumentaria americana, así la diferencia de
la L. trópica. Pedroso, en Brasil (1913), reporta por
primera vez un perro infectado por leishmania. Montenegro, en
1924, demuestra la hipersensibilidad a la inyección
intradérmica de una suspensión de
leishmanias.
En el Perú, Escomel, en 1911, fue
el primero que halló leishmanias en un caso de espundia y,
en 1913, la Comisión de la Universidad de
Harvard concluye que la UTA es una leishmaniasis de variedad
cutánea y la espundia, una de tipo mucocutáneo.
Herrer y Battistine producen la primera infección
experimental en perros. En 1940, Geiman publica los hallazgos de
Leishmania brasiliensis en pacientes peruanos que presentaban UTA
y la inoculación en un perro reproduce la típica
lesión. Walton y col., en 1977, caracterizan como
Leishmania brasiliensis spp. a una cepa aislada de un paciente
procedente de la región este del Perú que
presentaba espundia. Lumbreras y Guerra (1985)
escriben que la L. brasiliensis y la L. brasiliensis guyanensis
son los agentes que causan la espundia. Llanos Cuentas y col.
(1986) reportan la identificación de Leishmania
brasiliensis brasiliensis en pacientes con espundia. Lucas y
col., en 1994, aíslan en el Perú la Leishmania
(viannia) lainsoni. Otros investigadores peruanos que han
contribuido en el estudio de la leishmaniasis han sido Palma,
Monge, Arce, Rebagliati, Escomel, Almenara, Pesce y Weiss. En la
actualidad, diversos investigadores peruanos están
caracterizando las áreas endémicas de
leishmaniasis.
AGENTE
ETIOLÓGICO
El agente etiológico de la
leishmaniasis es un protozoario dimórfico del género
Leishmania, que pertenece al reino Protista, subreino Protozoa,
orden Kinetoplastida y a la familia
Trypanosomatidae. En la actualidad, el género Leishmania
se divide en dos subgéneros, según su desarrollo en
el intestino de los flebótomos vectores:
Leishmania, en el intestino medio o anterior, y Viannia, en el
intestino posterior, medio y anterior de los
flebótomos[7]. Morfológicamente las
distintas especies de leishmania no se pueden identificar. Para
llegar a la clasificación de las especies del
género leishmania se debe considerar ciertas
características:
a)
biológicas: morfología, tipo de desarrollo en el
flebótomo vector, crecimiento en los medios de
cultivo, desarrollo en el hospedador vertebrado;
b)
bioquímicas: electroforesis de isoenzimas, análisis del ADN del
núcleo y del cinetoplasto;
c)
inmunológicas: reactividad del parásito con
anticuerpos monoclonales y serotipificación del factor de
excreción y taxonomía
numérica para definir mejor la evolución molecular y la relación
filogenética de los parásitos del género
leishmania.
Las leishmanias se presentan bajo dos
formas diferentes. Una, promastigota, que es móvil y
flagelada, comúnmente encontrada en el vector
invertebrado, libre, alargada, de 10 a 14 por 1,5 a 3,5 mm, se
multiplica en el vector y migra a la parte anterior del mosquito
y está allí hasta ser inoculada (Figura 3). Y la
otra, amastigota, es inmóvil, intracelular, dentro de los
macrófagos y otras células
del sistema
reticuloendotelial del huésped vertebrado, redondeada u
ovoide, de 2,5 a 5,0 por 1,5 a 2,0
mm[8].

En el Perú se han identificado
cinco especies de leishmania:
1)
Leishmania (V) brasiliensis;
2)
Leishmania (V) guyanensis;
3)
Leishmania (V) peruviana;
4)
Leishmania (V) lainsoni;
5)
Leishmania (L) amazonensis.
En la amazonía se reconocen tres
especies como agentes causantes de leishmaniasis llamada
también leishmaniasis selvática o espundia: L. (L)
amazonensis, L. (V) guyanensis y L. (V) brasiliensis. Esta
última es la de mayor importancia en esta región
(Figura 4).

Entre los 600 y 2 000 msnm (Ayacucho,
Pasco, San
Martín, Huánuco) se ha reportado la presencia
de L. (V) lainsoni[9]. La forma cutánea
andina, llamada UTA, es causada por la L. (V) peruviana, que se
desarrolla entre los 600 y 3 000 msnm.
En América
Latina, los subgéneros de Leishmania y Viannia
contienen numerosas especies de las que sólo algunas
infectan al hombre:
Subgénero Leishmania
Leishmania (Leishmania) chagasi
*
L. (L) enrietti
L. (L) mexicana*
L. (L) pifanoi*
L. (L) hertigi
L. (L) amazonensis*
L. (L) deanei
L. (L) aristidesi
L. (L) garhami*
L. (L) venezuelensis*
L. (L) forattinii
Subgénero Viannia
Leishmania (Viannia)
brasiliensis*
L. (V) peruviana*
L. (V) guyanensis*
L. (V) panamensis*
L. (V) lainsoni*
L. (V) shawi
L. (V) naiffi*
L. (V.) colombiensis
L. (V.) equatorensis
* Especies que infectan al
hombre[10]
CICLO
BIOLÓGICO DE LA LEISHMANIA
Todas las leishmanias presentan un
ciclo de vida
similar y es importante conocer cada una de las etapas para
poder entender
y aplicar ciertas medidas de control. La
leishmania es heterogénea y completa su ciclo
biológico usando dos huéspedes. Se pueden producir
diferentes ciclos (Figura 5): Uno, principalmente silvestre, en
el que la leishmania circula entre los reservorios naturales, y
mantiene el ciclo con la participación de los vectores
propios de la zona endémica. En un segundo ciclo, los
vectores infectados pueden atacar al hombre y a los animales
domésticos o peridomésticos. Se puede producir un
tercer ciclo, en el que el propio enfermo con leishmaniasis se
constituye en reservorio.

El ciclo empieza cuando el vector toma
sangre de un
vertebrado infectado, para alimentarse, e ingiere
macrófagos infectados con amastigotes presentes dentro de
la piel. La
transformación del amastigote a promastigote ocurre dentro
de las siguientes 24 a 48 horas. Los promastigotes se multiplican
activamente por división binaria longitudinal. Algunos
quedan libres desde el inicio en el lumen intestinal; otros se
adhieren a la pared por hemidesmosomas. La localización
del parásito en el intestino varía de acuerdo a
cada especie de vector y de leishmania. Después de la
replicación en el intestino, los promastigotes migran al
esófago y la faringe. En el tubo digestivo de la hembra
del vector, los promastigotes son estructuras
piriformes o fusiformes que presenta la extremidad posterior
más delgada que la anterior, su cuerpo es flexible y se
mueve por la acción
de un flagelo libre situado en la parte posterior que es casi de
igual tamaño que el cuerpo; el núcleo se localiza
en el centro de la célula y
el cinetoplasto entre el núcleo y la extremidad anterior
somática; el rizonema parte del cinetoplasto y se
continúa con el flagelo
libre[11].
Cuando el vector infectado pica a un
huésped le inocula entre 10 y 100 promastigotes presentes
en la proboscis y que penetran en la dermis. La saliva del
mosquito tiene un rol en el establecimiento de la
infección, debido a que reduce la producción del óxido nitroso por los
macrófagos activados. En los vectores excesivamente
infectados, la proboscis está congestionada, lo que hace
difícil alimentarse, por lo que el mosquito realiza
múltiples picaduras e inoculaciones. Los promastigotes no
migran activamente hacia los macrófagos, permanecen en el
espacio intercelular y activan el complemento por una vía
alternativa, que inicia la acumulación de
neutrófilos y macrófagos. Aunque muchos
promastigotes son destruidos por los leucocitos
polimorfonucleares, unos pocos se transforman en amastigotes en
las células del sistema reticuloendotelial, en un periodo
de 3 a 4 horas en promedio[12], permanecen en
estadio estacionario por 36 horas aproximadamente y, luego,
empiezan a reproducirse.
La adhesión entre el
parásito y los macrófagos es una etapa fundamental
para la invasión de las células del huésped.
Sobre la superficie de la Leishmania han sido identificados
numerosos receptores, entre los más importantes la
glicoproteína 63 (gp63) y el lipofosfoglicano (LPG), que
son usados por los parásitos para adherirse a los
macrófagos. Las especies de Leishmania han desarrollado
varios mecanismos para resistir la actividad digestiva y
antimicrobiana de las células fagocíticas. Los
amastigotes son más resistentes que los promastigotes a
los mecanismos antimicrobianos inducidos por citoquinas
dependientes del oxígeno, lo que refleja una
adaptación al crecimiento intracelular.
El amastigote tiene forma ovalada o
redondeada, carece de flagelos y de membrana ondulante y, por
tanto, es inmóvil. En los preparados teñidos con
Wright y Giemsa se observa una membrana citoplasmática,
que le sirve de sostén y envoltura; un citoplasma azul
claro y, ocasionalmente, un cariosoma central o
excéntrico. En el citoplasma está incluido el
núcleo de color rojo
púrpura, de localización excéntrica,
dirigido un poco hacia la extremidad posterior. El cinetoplasto,
que se tiñe intensamente de rojo y que se ubica cerca y
delante del núcleo, es una estructura
mitocondrial especializada que contiene una cantidad sustancial
del ADN extranuclear, contiene el corpúsculo parabasal y
un blefaroplasto puntiforme. El axonema o rizonema es un
filamento que parte del cinetoplasto y se dirige a la membrana
celular.
Los amastigotes se multiplican por
fisión binaria dentro de vacuolas parasitóforas de
los macrófagos. Primero, inician la división del
cinetoplasto, uno de los fragmentos conserva el rizonema,
mientras que el otro forma su propia estructura flagelar. Luego,
sigue la división del núcleo por mitosis y
concluye con la del citoplasma, en sentido anteroposterior. La
cantidad de amastigotes puede llegar hasta 200, lo que ocasiona
la distensión y ruptura del macrófago. Los
amastigotes libres entran en nuevas células del sistema
fagocitario mononuclear, donde se multiplican de nuevo. El ciclo
se reanuda cuando el flebótomo pica a un huésped
para alimentarse de sangre.
EL VECTOR
La leishmaniasis es transmitida por la
picadura de flebótomos, pequeñas moscas que abundan
todo el año en las zonas tropicales y en el verano, en las
zonas templadas. Se reconocen cinco géneros de
flebótomos principales: Phlebotomus, Sergentomya,
Lutzomyia, Warileya y Brumptomya. Pero, se reconocen como
vectores de la leishmania solo a dos: En Europa, Asia y África, el
género Phlebotomus, y en América, el género
Lutzomya.
En el Perú, a la Lutzomyia se la
conoce con el nombre de 'manta blanca' o 'titira'. Puede habitar
en áreas desérticas, en la floresta y en
áreas peridomésticas. Sin embargo, prefiere los
lugares húmedos oscuros, en los que existe abundante
vegetación. Descansa de día en los
rincones, anfractuosidades de las piedras, muros o troncos de los
árboles, y vuela al atardecer. Las hembras
son las únicas hematófagas y más activas a
la caída del día. La lutzomyia es un mosquito
pequeño, de 1,5 a 3 mm de tamaño, su cuerpo
está cubierto de pelos y tiene las alas erectas en forma
de 'V' (Figura 6). Su forma de vuelo es muy particular, a manera
de brincos o saltos y mantiene un vuelo bajo y silencioso. El
área de su vuelo puede abarcar hasta 200 m de donde se
cría; sin embargo, puede ser transportado por el viento a
distancias mayores. Son, por lo general, de aparición
vespertina entre las 18 y 20 horas y desaparecen progresivamente
hacia la noche.

En el Perú se han descrito 131
especies de Lutzomyia, de las cuales cinco son vectores de la
leishmaniasis tegumentaria. La especie que predomina es la
Lutzomyia peruensis, que es vector de la leishmania en las
provincias de Huarochirí, Otuzco y Bolognesi; L.
ayacuchensis, en las provincias de Lucanas y Parinacochas; L.
verrucarum, en las provincias de Bolognesi y Huarochirí,
L. tejadai, en las provincias de Ambo y Huánuco; L. pescei
se correlaciona geográficamente con algunas áreas
de leishmaniasis[13] (Figura 7).

RESERVORIO
Existe una gran variedad de animales
silvestres y domésticos que han sido implicados como
reservorios de las especies de Leishmania en América. Es
evidente la relación ecológica estrecha que existe
entre los vectores de un parásito y su animal
reservorio.
En las áreas andinas, se ha
encontrado infectado naturalmente al perro doméstico
(Canis familiaris), Didelphys albiventis y a una gran variedad de
roedores, que incluye a la rata (Rattus rattus), entre otros. Se
ha encontrado, en algunos estudios, que los parásitos
aislados en el hombre y en
la rata pertenecen a la misma especie. En la selva, aún no
se ha podido determinar los reservorios.
En Brasil se ha encontrado como
reservorios de la L. (L) amazonensis a los marsupiales y
principalmente a los roedores Proechymis y al Oryzomys; de la L.
(V) guyanensis, al perezoso (Choloepus didactylus),
tamandúa (Tamanduá tetradáctila),
marsupiales y roedores; de la L. (V) brasiliensis, a animales
domésticos como perros, equinos, mulas y roedores
domésticos.
TRANSMISIÓN
Todas las especies de Lutzomyia pueden
ser potencialmente vectores de las leishmanias y
dependerán de sus preferencias por alimentarse. Las
especies que pican al hombre para alimentarse son las que pueden
transmitir la enfermedad, mientras que las especies que nunca o
solo ocasionalmente pican al hombre pueden ser muy importantes en
el mantenimiento
de las leishmanias en los reservorios animales. La mayoría
de las especies es silvestre y solo ataca a los hombres que
penetran en su hábitat. Existen algunas especies que
muestran una antropofilia acentuada y se adaptan al domicilio y
peridomicilio humano. Las hembras son las responsables de la
transmisión de la enfermedad.
ASPECTOS
EPIDEMIOLÓGICOS
La leishmaniasis en una enfermedad de
amplia distribución geográfica en el mundo,
y abarca zonas áridas, tropicales y subtropicales. Su
incidencia ha aumentado en los últimos años, hasta
en un 500%, según la OMS[14]. Ocurren
alrededor de 1,5 millones de nuevos casos de leishmaniasis
cutánea cada año, de los cuales más del 90%
se da en Afganistán, Argelia, Irán,
Irak, Arabia
Saudita y Siria, y en América, en Brasil y Perú. La
leishmaniasis cutánea americana es endémica en
América Central y América del Sur, con
excepción de Chile y Uruguay.
En el Perú, la leishmaniasis es
endémica y constituye un grave problema de salud pública. La
incidencia anual de todas las manifestaciones clínicas de
leishmaniasis americana aumentó de 7,6 por 100 000 a 24,7
por 100 000, entre 1979 y 1989, según el Ministerio de
Salud. Existen las formas cutáneo andina y la
mucocutánea o selvática, que son endémicas
en 12 departamentos del Perú: Ancash, Ucayali,
Junín, Loreto, San Martín, Amazonas, Ayacucho,
Cajamarca, Cusco, Huánuco, Cerro de Pasco y Madre de Dios;
primariamente en los Andes y en la Amazonía. La
población en riesgo es
aproximadamente de 1 200 000 personas. La mayoría de los
casos en el Perú es causada por L. brasiliensis y,
ocasionalmente, por L. peruviana.
La frecuencia es mayor en los adolescentes y
adultos jóvenes. La forma cutánea andina afecta
predominantemente a los menores de 15 años -en especial, a
los niños
menores de 5 años- y la forma mucocutánea, al
grupo mayor de
15 años. La leishmaniasis es considerada como una
enfermedad ocupacional en las personas que se trasladan por
motivo de trabajo a las
áreas endémicas. En las áreas de
transmisión de la forma cutánea andina hay una
rápida incorporación de menores de 15 años a
actividades de desbroce y preparación del terreno de
cultivo, y a la transmisión intra y peridomiciliaria. La
transmisión de la forma mucocutánea se relaciona
con la migración
intermitente y la colonización de áreas poco
exploradas de la Selva Alta y Baja, asociadas a actividades de
extracción y explotación de oro, petróleo, madera y
construcción de
carreteras[15].
No existe predilección por alguna
raza ni sexo. Sin
embargo, la incidencia es más alta en los hombres,
posiblemente como resultado del contacto ocupacional.
Incidencia
En el año 2003 fueron reportados 6 318 casos de
leishmaniasis cutánea en el Perú, la mayoría
procedía de Ancash, seguida por Cusco y Madre de Dios, y
327 casos de leishmaniasis mucocutánea, en su
mayoría del Cusco, seguida de Huánuco y Loreto. La
tasa de incidencia acumulada nacional es de 23,62 por 100 000
habitantes, para la leishmaniasis cutánea, y de 1,22 por
100 000 habitantes, para la mucocutánea[16].
FISIOPATOLOGÍA
Inmunología
La inmunidad en la leishmaniasis depende de la forma
clínica y la respuesta del huésped. Se ha descrito
un espectro de fenotipos que se correlacionan con la intensidad
de la respuesta inmune. La inmunidad mediada por células
tiene una influencia dominante en la determinación de la
enfermedad[17].
Tanto el parásito como el
huésped intervienen en el desarrollo de la
infección causada por la leishmania. Las leishmanias
poseen una serie de estrategias
complejas para atacar, infectar y sobrevivir dentro de los
macrófagos. El huésped falla para controlar la
enfermedad debido a la habilidad que tienen algunas cepas de
resistir a la acción microbicida de los macrófagos
activados y a la caída de la respuesta inmunoprotectora
del huésped. En el humano hay fenotipos sensibles y
resistentes. Las lesiones que curan espontáneamente
están asociadas con una respuesta positiva de las
células T antígeno específicas; las formas
viscerales y cutáneas difusas, con una respuesta
débil o ausente, y la forma muco cutánea, con una
hipe respuesta de las células T.
Los promastigotes cuando son inoculados,
para escapar de la respuesta inmune inespecífica del
huésped, penetran en los macrófagos. Los
promastigotes no migran hacia los macrófagos, sino que
permanecen en el espacio intercelular y activan el complemento
por la vía alterna, e inician la acumulación de
neutrófilos y macrófagos.
La adhesión entre el
parásito y los macrófagos es fundamental para la
invasión de las células del huésped. La
proteína sérica C3 del complemento se deposita en
la superficie del protozoario y reconoce ciertos receptores de
membrana del macrófago. Se han identificado otros
receptores sobre la superficie de la leishmania, como la
glicoproteína 63 (gp63) y el lipofosfoglicano (LPG), que
son usados por los parásitos para adherirse a los
macrófagos. Una vez que los promastigotes se fijan al
macrófago son englobados en una vacuola
parasitófora, que se une a los lisosomas y contienen
enzimas
proteolíticas que pueden matar y digerir las
leishmanias.
Sin embargo, las leishmanias se
diferencian y se transforman en amastigotes que resisten a la
agresión y se multiplican dentro de estas vacuolas hasta
que los macrófagos infectados ya no pueden contener
más leishmanias y las células mueren y liberan
amastigotes que van a infectar otras células. Las
leishmanias destruidas por los macrófagos liberan
antígenos que son expresados en la membrana de los
macrófagos y presentados a los linfocitos T CD4+
leishmania específicos. La actividad leishmanicida es
debida al aumento de la capacidad de los macrófagos de
producir oxígeno tóxico y radicales de
nitrógeno en respuesta al interferón gama (IFN-
g).
Los análisis del perfil de
citoquinas sugieren que el sistema inmune del huésped
tiene un rol inmunorregulatorio en la expresión de la
enfermedad. Así, en la leishmaniasis cutánea
localizada, las principales citoquinas producidas son la IL-2 e
IFN- g, y en la mucocutánea y la cutánea difusa, la
IL-4 e IL-10. Esto se correlaciona con los estudios en modelos
murinos en los cuales la producción de IL-2 e IFN-g (Th1)
interviene en la curación de la enfermedad, mientras que
las IL-4, IL-5 e IL-10 (Th2) están asociados con la
progresión y diseminación de la enfermedad.
Así dos subpoblaciones de células T helper en el
sistema inmune murino son críticos en la inducción de la resistencia o la
susceptibilidad a la
infección[18].
La importancia de la piel como sitio
inmunorregulatorio en las tres formas clásicas de
leishmaniasis y la vía de señal epidermal es
crucial en la determinación de la respuesta inmune
relacionada al tipo de citoquinas generado contra los
parásitos de leishmania.
La resolución de la
infección y la protección contra la
reinfección en humanos y ratones están reguladas
por la expansión de las células T helper CD4+
leishmania específicas tipo Th1 que producen IFN- g. El
IFN-g activa a los macrófagos para la destrucción
intracelular de los amastigotes. La IL-12 tendría un
importante rol en promover el desarrollo de la respuesta Th1
protectora. En modelos de ratones, las células CD8+
leishmania específica secretan IFN-g, que contribuye a la
resolución de la infección por L.
donovani.
En estudios de modelos en ratas se ha
demostrado que durante las infecciones sistémicas
progresivas hay expansión de células T CD4+ del
tipo Th2 que secretan IL-4, pero no IFN-g o IL-2 en respuesta a
antígenos leishmaniales. La IL-4 suprime el desarrollo de
la respuesta Th1 y la activación de los macrófagos
por el IFN-g. En pacientes con leishmaniasis visceral, la IL-10,
más que la IL-4, es responsable de la supresión de
la respuesta Th1. Las células CD8+ leishmania
específicas han sido implicadas en la estimulación
de la secreción de IL-10 por las células
mononucleares de la sangre periférica. La naturaleza
crónica de la leishmaniasis cutánea parece ser
debida a la respuesta Th2 dominante en el sitio de
infección de la piel.
El mayor mecanismo de defensa inmune que
tiene el huésped frente a la leishmania es la
activación de los macrófagos por el IFN-g derivado
de las células T CD4+. La ausencia de IFN-g es responsable
del desarrollo de la leishmaniasis visceral y la leishmaniasis
cutánea difusa. En la leishmaniasis cutánea
americana, los linfocitos T producen IFN-g, en respuesta a
antígenos de las leishmanias, y activan el
macrófago para destruir a las leishmanias. Es posible que
el desarrollo de la enfermedad dependa de la desregulación
transitoria de la respuesta de las células T durante la
fase inicial de la
infección[19].
Recientes estudios están
descubriendo la importancia de las interacciones entre los
microorganismos y las células dendríticas (CD) y el rol
central de estas células en la iniciación y
regulación de la respuesta inmune antimicrobial. Las CD
inmaduras en la piel captan el antígeno y lo procesan para
su presentación a través de moléculas del
complejo mayor de histocompatibilidad (MHC). Posteriormente, las
CD migran por los nódulos linfáticos transportando
el antígeno procesado a las áreas de las
células T, diferenciándose en CD maduras con
capacidad para estimular las células T en reposo, que da
lugar a la producción de citoquinas, como IL-1, IL-6 o
IL-12, las que modulan el desarrollo del tipo de respuesta de
células T. En la leishmaniasis, los protozoarios son
fagocitados por macrófagos, CD, neutrófilos y
fibroblastos. Solo las CD migran por los nódulos
linfáticos y transportan el antígeno desde la piel
infectada hacia las áreas de las células T y son
capaces de proporcionar la principal señal para la
iniciación de la respuesta primaria de las células
T leishmania específica. Además, las CD retienen
los antígenos del parásito de una forma
inmunogénica por periodos prolongados, debido al aumento
de la estabilidad de complejos péptidos del MHC de
clase II, y
así permitir la estimulación sostenida de las
células T parásito específicas, que mantiene
la inmunidad protectora frente a las leishmanias. Estos hallazgos
sugieren que la interacción de la leishmania con las CD es
enfocada como iniciadores y reguladores de la respuesta inmune
específica. Se ha determinado que la IL-12 en un estadio
temprano de la infección es crucial para la
determinación de la inmunidad innata, la actividad de las
células natural killer (NK) para producir IFN-g y la
respuesta adaptativa del huésped vía
inducción selectiva de la diferenciación de las
células Th1. Este hallazgo es la clave de las CD como
reguladores de la inmunidad antiinfectiva y para la
elaboración de estrategias para la obtención de
vacunas.
Histopatología
El patrón histológico, tanto en la forma
cutánea como en la mucocutánea, es el de una
reacción inflamatoria granulo matosa crónica, y el
aspecto microscópico varía de acuerdo a la
antigüedad de las lesiones y a los factores del
huésped. Las lesiones tempranas muestran un infiltrado
granulo matoso dérmico intenso de linfocitos,
macrófagos parasitados, células epitelioides,
algunas células gigantes, células
plasmáticas y, a veces, eosinófilos (Figura 8). En
la dermis superior, el número de neutrófilos es
variable. La epidermis muestra
hiperqueratosis, acantosis y, a veces, atrofia, ulceración
y abscesos intraepidérmicos. Las lesiones más
antiguas muestran un granuloma de células epitelioides e
histiocitos con células gigantes ocasionales y el
número de macrófagos parasitados es reducido. La
hiperplasia seudocarcinomatosa aparece en las lesiones de larga
duración[20].

ASPECTOS
CLÍNICOS
Las manifestaciones clínicas son
variables y
están relacionadas a la cepa de leishmania infectante, el
medio ambiente
y a la respuesta inmune del hospedero. Se describen cuatro formas
clínicas:
1)
leishmaniasis cutánea;
2)
leishmaniasis mucocutánea;
3)
leishmaniasis cutánea difusa y
4)
leishmaniasis visceral (Figuras 9).
En el Perú, se reportan la forma
cutánea andina o 'UTA' y la forma mucocutánea o
'espundia'. Se estima que el 75% a 80% de los casos reportados
corresponde a la forma cutánea y el 10% a 25%, a la forma
mucocutánea.

Leishmaniasis
cutánea
La aparición de las lesiones
cutáneas algunas veces se encuentra asociada con la
picadura del insecto vector en sujetos que viven en áreas
endémicas, penetran y permanecen en el nicho
ecológico por breves días y, luego, presentan la
enfermedad. En promedio, se puede hablar de un periodo de
incubación entre 2 y 3 semanas (de 2 semanas a 2 meses o
más). Después aparece una pequeña
lesión inicial frecuentemente visible, pero no siempre,
que tiene asiento en las partes descubiertas, principalmente en
la cara y en las piernas. El aspecto típico de la
lesión inicial es un leve enrojecimiento circunscrito,
frecuentemente pruriginoso, seguido, a los pocos días, por
una leve infiltración papulosa de unos 3 mm de
diámetro y con mucha frecuencia con una o dos diminutas
vesículas; puede dar lugar a una diminuta
excoriación por el rascado, que se transforma en una
exulceración y posible punto de partida de un proceso
ulcerativo. Pero, algunas veces, la lesión regresiona
espontáneamente y origina una fase de silencio
sintomático algo prolongado. Un trauma local puede activar
una infección latente[21].
Se ha observado como signo precoz en los
casos de leishmaniasis cutánea la aparición de
nódulos linfáticos, en la región
correspondiente. El inicio de los signos
linfáticos puede aparecer antes, al mismo tiempo o
después de la ulceración, y, en casos muy raros,
puede ser el único signo de infección de
leishmaniasis. Más raros, son diminutos cordones
linfáticos infiltrados, perceptibles a la
palpación, entre la lesión primaria y el ganglio
infartado. Esto puede considerarse como un 'complejo primario'
que la mayoría de veces pasa desapercibido por su escasa
intensidad, o sea una verdadera, pero diminuta, úlcera
primaria acompañada por la infiltración
linfática regional correspondiente. Algunas veces se ha
observado una lesión modular de tipo subdérmico,
sin lesión cutánea visible como punto de partida de
un infarto
ganglionar manifiesto. Esto indica que el complejo ganglionar es
la regla en la enfermedad, aunque no siempre pueda ser
evidenciable.
Después de varios días, la
lesión inicial se ulcera espontáneamente y se cubre
de un exudado amarillento y adherente, que dará lugar a la
costra. Debajo de la costra, la lesión se extiende en
superficie y profundidad. Pueden aparecer lesiones satélites
que al unirse a la inicial, originan una úlcera grande. La
úlcera característica de la leishmaniasis es
redondeada, indolora, con bordes bien definidos levantados y
cortados en forma de sacabocado e indurada que recuerda la
imagen de un
cráter. Cuando se desprende la costra se observa un fondo
granulo matoso, limpio, con exudado seroso no purulento, sin
tendencia al sangrado, de color rojizo, a veces amarillento
cuando hay depósito de fibrina. No hay signos
inflamatorios, como edema o calor local.
Si hay una infección bacteriana sobre agrega dable, la
úlcera se torna dolorosa, exudativa y purulenta. La piel
alrededor de la lesión presenta aspecto y
coloración normales[22] (Figura
10).

La localización de la
úlcera es más frecuente en las partes expuestas del
cuerpo, especialmente las extremidades y cara. En los primeros
meses de evolución, la úlcera tiende a crecer hasta
un tamaño máximo que está en función de
la respuesta inmune del huésped y de la especie de
Leishmania infectante. Pasan varios meses antes que la
úlcera alcance varios centímetros de
diámetro. Con frecuencia son afectados los ganglios
linfáticos y se producen linfangitis y linfadenitis
regionales. Las lesiones se estabilizan y a medida que empieza a
prevalecer la respuesta inmune del huésped, la enfermedad
tiende a evolucionar a la curación espontánea, en
un periodo de seis meses a tres años. Solo un escaso
porcentaje tiene recidivas cutáneas o complicaciones
mucosas de aparición más o menos
tardía.
Las especies de leishmania infectante y
la respuesta inmune del huésped determinan las
características clínicas y la cronicidad de las
lesiones. Las lesiones causadas por L. (L) mexicana tienden a ser
pequeñas y menos crónicas que las causadas por L.
(V) brasiliensis. La L. (V) peruviana presenta principalmente
formas papulofoliculares y nodulares dérmicas; en la
leishmaniasis causada por L. (V) brasiliensis predomina la forma
ulcerosa franca[23]. La leishmaniasis causada por
L. (V) guyanensis origina úlceras múltiples, que
sin tratamiento pueden extenderse por la cadena linfática
de forma similar a la esporotricosis; en un porcentaje bajo
muestra tendencia a la forma mucocutánea. La L. (V)
panamensis produce lesiones ulcerosas que no tienden a la
curación espontánea y afectación
linfática en forma de rosario. La leishmaniasis producida
por la L. (L) amazonensis rara vez produce enfermedad en el
hombre y tiende a producir leishmaniasis cutánea difusa
resistente a la curación. La L. (V) lainsoni produce
principalmente lesiones cutáneas.
Se ha descrito diversas formas
clínicas de lesiones no ulceradas de leishmaniasis, como
la papulosa, impetiginoide (Figura 11), verrucosa, nodular
(Figura 12), vegetante y mixtas.
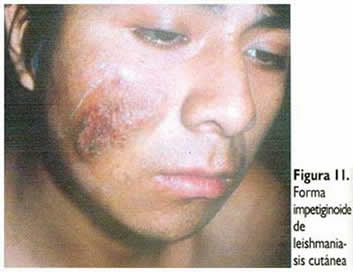

La leishmaniasis cutánea andina
produce usualmente sólo lesiones cutáneas. Sin
embargo, las membranas mucosas pueden estar ocasionalmente
comprometidas, directamente relacionadas a la contigüidad de
una lesión con la mucosa, en el caso de lesiones
producidas en la cara.
Leishmaniasis
mucocutánea (Figuras 13 y 14)
Las manifestaciones clínicas de
la forma mucocutánea se presentan muchos meses o
años después haber cicatrizado la forma
cutánea; ocasionalmente aparecen cuando todavía
existen las manifestaciones en la piel. Frecuentemente el enfermo
ya no se encuentra en la zona donde contrajo la enfermedad.
Tejada, en Cusco y Madre de Dios, encontró que el 48,8% de
las manifestaciones mucosas se inició uno a dos
años después de iniciada la enfermedad
cutánea; el 24%, a los dos años, y 20%, entre los 3
y 5 años[24]. Pessoa y col., en Brasil,
afirman que el 70% de las lesiones surge en los primeros 5
años después de la aparición de la
lesión cutánea. Se describe aparición de
lesiones mucosas entre los 20 y 30 años después de
la resolución de la lesión primaria. En un tercio
de los casos, las manifestaciones mucosas son primarias, sin
antecedente de lesión cutánea. Posiblemente la
infección primaria ha sido inaparente o se ha manifestado
como una lesión mínima que pasó
desapercibida para el paciente.



Las lesiones mucosas se inician
principalmente a nivel del tabique nasal cartilaginoso (septum
cartilaginoso) y, raramente, en el piso de la nariz. Pero, pueden
comenzar en otras partes de las vías aéreas
superiores. Al inicio solo se aprecia una discreta
secreción de moco, como si el enfermo tuviera una rinitis
o un resfriado. Luego, se produce la inflamación de la mucosa, que se vuelve
eritematosa, edematosa y dolorosa; la lesión se profundiza
y produce una pericondritis. Hay hipertrofia vascular y de los
orificios pilosebáceos, que produce abundante seborrea.
Cuando las lesiones están avanzadas, se presenta
exudación y ulceración de la mucosa. Luego, se
compromete el cartílago y se produce la perforación
del tabique, que si destruye parcial o totalmente el tabique
determinará la caída de la punta de la nariz. El
eritema, edema y la infiltración producen aumento del
volumen de la
punta de la nariz y el ala, que puede sobrepasar el surco
nasogeniano. A esta nariz grande de la leishmaniasis se la conoce
con el nombre de 'nariz de tapir'. La perforación del
tabique nasal y el achatamiento de la nariz sin ulceración
son propias de la leishmaniasis mucocutánea (espundia) y
no son observadas en la leishmaniasis cutánea andina, en
la que, de preferencia, las alas de la nariz son
carcomidas.
Los pacientes con compromiso nasal
presentan, como sintomatología, catarro nasal, ardor,
prurito y respiración forzada. Al examen, se aprecia
la mucosa nasal congestionada, una costra hemorrágica o
una úlcera granulomatosa infiltrada. Si hay
infección sobreagregada, la secreción es purulenta.
Si la enfermedad progresa y se profundiza, el proceso se extiende
del vestíbulo al labio superior, paladar, pilares,
úvula y la garganta. El labio superior suele ulcerarse y
destruirse poco a poco y compromete parte de la nariz. Las
lesiones del paladar son más frecuentemente proliferativas
que destructivas; la úvula suele hipertrofiarse, ulcerarse
o destruirse; pero, las lesiones linguales son muy raras. Cuando
se afecta la garganta, la voz es ronca y hay dificultad para
respirar y deglutir los alimentos.
También se puede hallar compromiso gingival e
interdentario. Las lesiones de la hipofaringe, laringe y
tráquea se caracterizan por un compromiso de los
repliegues ariteepiglóticos y aritenoides, que dan
lesiones hipertrofiantes que producen disfonía,
afonía y asfixia. La epiglotis también puede estar
comprometida y las cuerdas vocales
infiltradas[25]. Si no hay tratamiento, la
enfermedad puede llevar a la
muerte.
La leishmaniasis mucocutánea, en
los primeros años de su evolución, no afecta el
estado general
del paciente, el que puede realiza su labor normalmente. Sin
embargo, cuando las lesiones mucosas están muy avanzadas y
comprometen la mucosa de la boca y la laringe, la
respiración y la alimentación,
el estado
general del enfermo se altera.
Leishmaniasis cutánea
difusa
La leishmaniasis cutánea difusa
ocurre en un huésped enérgico con pobre respuesta
inmune celular. La enfermedad se inicia bajo la forma de lesiones
localizadas, de aspecto modular o en placa infiltrada, que poco a
poco se diseminan a todo el cuerpo. La presencia de
nódulos aislados o agrupados, máculas,
pápulas, placas infiltradas, úlceras y, algunas
veces, lesiones verrugosas de límites
imprecisos, que se confunden con la piel normal, dan el aspecto
de la lepra lepromatosa. La enfermedad no invade órganos
internos[26].
La leishmaniasis cutánea difusa
puede ser causada por L. aethiopica. En América Central y
Sudamérica es más comúnmente causada por la
L. mexicana amazonensis.
El examen histopatológico muestra
frecuentemente atrofia de la epidermis y granulosas bien
constituidos con predominio de células de citoplasma
vacuolado llenas de parásitos, en la dermis.
Las lesiones no curan
espontáneamente y tienden a la recaída
después del tratamiento.
Leishmaniasis visceral
La leishmaniasis visceral es una
enfermedad parasitaria sistémica que compromete la vida,
causada por el complejo L. donovania y transmitida por mosquitos
flebótominos. La enfermedad es endémica en muchas
regiones tropicales y subtropicales del mundo. El complejo
Leishmania donovani incluye a la L. donovani en el subcontinente
Indio, Asia y África; a la L. infantum, en el
mediterráneo y L. chagasi, en Sudamérica. En el
Oriente medio se han encontrado cepas de L. trópica que
causan enfermedad visceral. La leishmaniasis visceral ocurre
esporádicamente en áreas endémicas rurales,
pero epidemias en gran escala se han
asociado al hambre, migraciones en masa y alteraciones
ecológicas, las que han propiciado interacciones entre los
reservorios, mosquitos y seres humanos.
Después de la picadura del
vector, existe un periodo de incubación que varía
de 4 a 10 meses. En muy pocos casos se encuentran lesiones en la
puerta de entrada, ya que la mayoría de las veces pasa
desapercibida y tiene una evolución crónica. La
progresión a leishmaniasis visceral típica
usualmente ocurre entre los 3 y 8 meses después de la
infección; aunque se han reportado casos tempranos, como
de dos semanas. Sin embargo, después de la
infección la mayoría de los casos permanece
asintomática o está asociada con síntomas
leves que, eventualmente, se resuelven en forma
espontánea.
Las manifestaciones clínicas de
la leishmaniasis visceral típica están asociadas
con fiebre, la que
casi siempre es progresiva y elevada, remitente o intermitente,
que dura semanas y se alterna con periodos febriles, que
también duran semanas. Posteriormente, la fiebre se torna
persistente y ondulante. Existe progresivo deterioro del
huésped, palidez y hepatoesplenomegalia. En la fase
crónica, la esplenomegalia es muy marcada y puede llegar
hasta la fosa iliaca derecha, con abultamiento considerable del
abdomen. Existe una linfadenopatía generalizada, en
especial de los ganglios mesentéricos, epistaxis,
hemorragia gingival, edema y ascitis. La leishmaniasis visceral a
menudo es fatal si no se efectúa tratamiento adecuado. La
piel se encuentra hiperpigmentada.
Los hallazgos de laboratorio
incluyen anemia
normocítica normocrómica, neutropenia,
trombocitopenia, hipoalbuminemia y elevación de las
transaminasas.
Desde el punto de vista
inmunológico, se ha establecido que la leishmaniasis
visceral está asociada con anergia celular, tal como lo
indican las pruebas
cutáneas negativas a antígenos de leishmania. La
inducción del factor de transformación del
crecimiento-beta y la IL-10 con propiedades inactivantes de los
macrófagos puede ser la clave de esto. El control de la
leishmaniasis visceral depende de la magnitud de la respuesta Th1
y de las citoquinas liberadas tempranamente en el curso de la
infección. Datos recientes
indican que la susceptibilidad a la leishmaniasis está
genéticamente determinada.
DIAGNÓSTICO DE
LEISHMANIASIS
La aproximación
diagnóstica más exacta considera tres criterios que
deberán abordarse en el siguiente orden:
Antecedentes
epidemiológicos,
Cuadro clínico sugestivo de
leishmaniasis, y
Exámenes de laboratorio: métodos
directos e indirectos[27].
ANTECEDENTES
EPIDEMIOLÓGICOS
Es importante conocer el lugar de
procedencia del paciente, las residencias anteriores, la
permanencia o la visita a áreas endémicas de
leishmaniasis, los antecedentes ocupacionales relacionados, como
el trabajo en
los lavaderos de oro, la recolección de café o
de cacao en la selva del Perú.
Además, es importante indagar
sobre la presencia de lesiones cutáneas anteriores que
puedan haber sido catalogadas como leishmaniasis o no, y que, con
el antecedente de haber permanecido en un área
endémica, demoraron en la cicatrización.
CUADRO
CLÍNICO
Las manifestaciones clínicas son
variables y están relacionadas en parte a la especie de
Leishmania, al medio ambiente y a
la respuesta inmune del hospedero. Las formas clínicas ya
descritas corresponden a: leishmaniasis cutánea,
mucocutánea, cutánea difusa y visceral. La
última aún no ha sido reportada en el Perú.
La localización y el diagnóstico clínico precoz previenen
la aparición de complicaciones y secuelas
destructivas.
Definición de casos de
leishmaniasis
Caso probable. Caso de leishmaniasis
diagnosticado bajo criterio clínico-epidemiológico,
sin confirmación por exámenes de
laboratorio.
Caso confirmado. Caso probable que
sometido a exámenes parasitológico,
inmunológico e histopatológico o cultivo demuestra
positividad a la infección por leishmania.
DIAGNÓSTICO DE
LABORATORIO
Siempre se debe tener en cuenta que los
procedimientos
empleados en el diagnóstico de leishmaniasis tegumentaria
americana (LTA) dependen, en gran parte, de la finalidad e
infraestructura del laboratorio en que se trabaja. Por otro lado,
se sabe que, debido al polimorfismo clínico de la LTA, la
obtención de las muestras variará según los
métodos de demostración y aislamiento de los
parásitos. Los exámenes de laboratorio se agrupan
en directos o parasitológicos e indirectos o
inmunológicos.
Métodos directos o
parasitológicos
En el diagnóstico
parasitológico hay dos alternativas. La primera es
demostrar que el paciente está albergando la leishmania,
mediante la visualización, en el frotis o en la
histopatología, de amastigotes en tejidos
infectados. La segunda opción es intentar el aislamiento
directo de los promastigotes en cultivos in vitro de las lesiones
sospechosas[28].
Otro método
empleado es la inoculación de animales de laboratorio
(hámsters dorados) y ratones isogénicos y no
isogénicos, a partir de los que se puede aislar y
caracterizar a la Leishmania a través de PCR
(reacción en cadena de la polimerasa), anticuerpos
monoclonales y/o electroforesis de isoenzimas.
Investigación de
amastigotes
En las lesiones
cutáneas
La úlcera es la más
frecuente presentación clínica de la LTA.
Independientemente de la especie de leishmania causante, las
lesiones, por lo general, se encuentran contaminadas por hongos, bacterias o
mico bacterias. Por ello, se debe realizar una buena asepsia,
previa a la toma de muestra. Cuando los parásitos
circulantes en el área endémica pertenecen al
subgénero Viannia, la eficiencia de
visualización y aislamiento es menor en los frotises si se
compara con las leishmanias del subgénero Leishmania,
debido a las densidades parasitarias de 18 a 52% y de 30 a 40%,
respectivamente.
La positividad de la histopatología con
hematoxilina-eosina está alrededor del 48% en el
Perú[29]; sin embargo, existen reportes de
que en Brasil solo se alcanza entre 18 y 28% en leishmaniasis
cutánea. La técnica de inmunoperoxidasa indirecta
(IMPI) es muy eficiente en la observación y localización del
parásito, con 61% de positividad, y si la lesión
tiene menos de 3 meses de evolución, puede alcanzar el
75%.
En las lesiones
mucosas
En relación con las formas
mucosas únicas o múltiples, los procedimientos
generalmente utilizados son la biopsia con ayuda de pinzas
cortantes especiales (cutting biopsy punch) y los frotises de las
biopsias. La L. (V) brasiliensis es difícil de
diagnosticar en los granulomas mucosos. Llanos-Cuentas en
Perú, reporta 48% de positividad en lesiones mucosas
únicas y 72,7% en lesiones múltiples, mientras que
Cuba, en
Brasil, halla 27,4% en los frotises de las biopsias y 16% en la
histopatología. Estos resultados son opuestos a los de
Dimier-David, en Bolivia, que
publicó una positividad de 17,7% para los frotises y
28,4%, para la histopatología. Marsden llama la atención que es más fácil
detectar los parásitos en lesiones mucosas
múltiples, que en lesiones únicas de L. (V)
brasiliensis, lo cual también fue reportado por
Dimier-David.
Investigación de
promastigotes
De las fases evolutivas de Leishmania,
la forma promastigote es la más fácil de ser
cultivada in vitro, en ella se hacen la mayoría de las
investigaciones
parasitológicas[30].
Ya en la década del 70, era
opinión generalizada que los parásitos
pertenecientes al hoy, subgénero Viannia (complejo
brasiliensis), eran difíciles de cultivar. Este hecho era
completamente opuesto a la facilidad con que se cultivaban las
leishmanias del subgénero Leishmania (complejo mexicana)
en cualquier medio agar sangre. Hoy sabemos que no existe un
único medio de cultivo artificial capaz de reunir
características tales que consiga cumplir los objetivos
enunciados. Por tanto, es recomendable que cada área
endémica de LTA, ensaye primero algunos medios conocidos
por su sensibilidad. Esto permitirá una mayor eficiencia
futura en el aislamiento de los parásitos que circulan en
el foco de transmisión. Los medios de cultivo empleados
pueden ser monofásicos (Eagle, MEM, 19TC, el medio RPMI
1640 y el Schneider), o bifásicos (Agar sangre-NNN, Agar
sangre USAMRU, medio de Senekjie).
Métodos de
cultivo
Aislamiento primario de las lesiones
cutáneas
La sensibilidad del método
está directamente relacionada con la correcta selección
que hagamos del medio más apropiado y con la habilidad del
investigador para escoger el lugar de la lesión que sea la
de mayor actividad parasitaria (la que sólo surge
después de años de experiencia y práctica).
Para la recolección de la muestra para el cultivo, podemos
usar la técnica de aspiración de las lesiones por
el procedimiento
descrito por Hendricks o a través de una biopsia punch y
posterior triturado en una solución de suero
fisiológico y antibióticos. Es importante
señalar que la excesiva presencia de sangre en las
muestras colectadas es perjudicial para el desarrollo del
parásito. Según Evans, la sangre contiene proteínas
séricas altamente inhibitorias para el crecimiento de los
promastigotes de leishmania.
Aislamiento primario de las lesiones
mucosas.
Es bastante difícil aislar
Leishmania de los granulomas mucosos, en medios de cultivo, tanto
por la
contaminación de bacterias y hongos ambientales como
del huésped. Por ello los cultivos deben contener
antifúngicos (5-fluorocitosina) y antibióticos
(gentamicina y estreptomicina) a 4°C durante 24 horas. Esto
se realiza previo a la inoculación de los tubos de
cultivo. Sin embargo, la eficacia es poco
significativa. El mejor hallazgo lo reporta Cuba en Brasil con
30%, mientras que Dimier-David, en Bolivia, consiguió 23%
de positividad en medio NNN complementado con Schneider y
antibióticos.
Uso de la inoculación en
hámsters en el diagnóstico de LTA
Con el empleo de este
método, Cuba reporta 60% de positividad en animales
inoculados con la suspensión de la biopsia triturada, y de
solo aproximadamente 35%, cuando proceden a aspirar con aguja y
jeringa las lesiones e inmediatamente inoculan los animales. En
Perú, Llanos-Cuentas reporta 69,9% de positividad. Para
comprobar el parasitismo del hámster inoculado no basta
hacer un simple frotis del lugar clínicamente positivo, es
necesario cultivar, ello porque el frotis apenas
demostrará 25% de animales con amastigotes.
En la leishmaniasis, tanto
cutánea como mucosa, el éxito
en el aislamiento es inversamente proporcional al tiempo de
duración de la enfermedad. Se debe admitir que no existe
una técnica de aislamiento que reúna todas las
características necesarias a fin de diagnosticar
parasitológicamente el 100% de los pacientes con LTA. La
opinión generalizada es que el máximo rendimiento
se consigue con la combinación de 2 ó 3 de ellas.
Si a esto se asocian la prueba de Montenegro y la
serología por Elisa, el diagnóstico laboratorial de
LTA puede llegar al 90,0%.
Métodos
inmunológicos
Se basan en la detección de la
enfermedad a través de la respuesta inmune celular
(intradermorreacción de Montenegro o leishmanina) y/o
respuesta inmune humoral a través de anticuerpos
específicos desarrollados como consecuencia de la
enfermedad (Elisa/DOT Elisa, inmunofluorescencia indirecta
(IFI)[31].
Intradermorreacción de
Montenegro
Es una reacción de
hipersensibilidad tardía que evalúa la inmunidad
mediada por células. Consiste en la aplicación de
un antígeno extracto soluble preparado a partir de
promastigotes procedentes de cultivo. Se aplica
intradérmicamente en la cara anterior del antebrazo
izquierdo del paciente y se hace la lectura a
las 48 a 72 horas. Se considera positiva si es mayor de 10 mm. La
prueba aparece positiva 1 a 3 meses después de haber
adquirido la infección y permanece positiva de por vida en
pacientes con LCL y LCM, y es negativa en los pacientes con LCD,
forma visceral y en inmunosuprimidos. Tiene un 96% de positividad
en los tres primeros años de iniciada la
enfermedad.
Inmunofluorescencia indirecta (IFI) y
pruebas enzimáticas Elisa
Estas pruebas detectan anticuerpos
antileishmania circulantes en el suero del paciente a
títulos bajos. En las lesiones ulceradas por L. (V)
brasiliensis la sensibilidad a la IFI está en torno del 70%
dentro del primer año de iniciada la enfermedad. Algunos
pacientes son persistentemente negativos.
Las lesiones múltiples, tanto
cutáneas como mucosas, están asociadas a
títulos más altos. De otro lado, las lesiones
mucosas presentan títulos más altos que las
lesiones cutáneas y muestran títulos elevados
persistentemente[32].
Después del tratamiento y la cura
clínica en ambas formas de la enfermedad, los
títulos caen o desaparecen completamente. Un tercio de los
pacientes permanecen seropositivos después de los 30
años de enfermedad.
La primera muestra debe recolectarse en
el primer contacto con el paciente, la segunda al mes, la tercera
a los 3 meses, otra a los 6 y la última al año de
la cicatrización de la lesión.
Reacción en cadena de la
polimerasa (PCR)
Es un método que se está
usando rutinariamente para confirmar el diagnóstico de
leishmaniasis. La identificación puede ser hecha de una
biopsia sin requerir necesariamente un cultivo. Los resultados
comparativos entre la PCR y los métodos de
detección parasitológicos muestran una mejor
sensibilidad del primero para fines de
diagnóstico.
DIAGNÓSTICO DIFERENCIAL
Es importante realizar un
diagnóstico diferencial cuidadoso con otras entidades que
pueden producir lesiones semejantes. Se debe considerar el medio
geográfico donde se encuentra trabajando el paciente y
cuales son las patologías más frecuentes en esa
zona, que podrían confundirnos con
leishmaniasis.
Leishmaniasis cutánea andina:
infecciones de piel ocasionadas por bacterias piógenas,
úlceras por vasculopatía, lepra lepromatosa,
tuberculosis,
sífilis
secundaria o terciaria, micosis superficiales, sarcoidosis y
carcinomas de piel.
Leishmaniasis mucocutánea:
infecciones de mucosas ocasionadas por paracoccidioidomicosis, histoplasmosis, tuberculosis nasal, sífilis
terciaria, granuloma letal de la línea media, pian,
hanseniasis y neoplasias.
Leishmaniasis visceral: infecciones
infantiles como malaria crónica, linfomas, esprue tropical
y leucemias. En Perú no ha sido reportada esta forma
clínica, pero existen en países limítrofes
como Brasil, Bolivia y Colombia.
TRATAMIENTO
Gaspar Vianna, en 1909, inicia el
tratamiento específico de la leishmaniasis utilizando
tártaro emético y obtiene la cura de pacientes con
leishmaniasis cutánea y/o mucosa. Este medicamento
ocasionaba severos efectos colaterales. Bramachari, en 1920,
sintetiza el primer antimonial pentavalente, pero los
antimoniales trivalentes fueron las drogas
utilizadas, con efectos colaterales menos intensos que el
tártaro emético, presentando toxicidad cardiaca,
hepática y del sistema nervioso
central. En la década de los 40 entra en el mercado
farmacéutico los antimoniales pentavalentes, el
estibogluconato de sodio (Repodral®/Pentostan®) y
N-metilglucamina (Glucantime®).
Los esquemas de tratamiento se aplican
de acuerdo a la forma clínica de leishmaniasis. En el
Perú se manejan dos líneas básicas de
tratamiento: primera línea, con antimoniales
pentavalentes, y segunda línea, con anfotericina
B.
Para el tratamiento
antileishmaniásico se están empleando esquemas de
tratamiento alternativo y se están desarrollando nuevos
medicamentos. Los esquemas utilizados son:
LEISHMANIASIS
CUTÁNEA ANDINA O UTA
Droga de
elección
Los antimoniales pentavalentes, a la
dosis de 20 mg Sb/kg de peso/día, vía IV o IM, por
10 días, aplicación diaria. La experiencia que se
tiene es con los antimoniales pentavalentes (N- metilglucamina);
se presentan en ampollas de 1,5 g. Son empleados por vía
IM, cada 12 horas, en ciclos de 10 días cada uno y
descanso de una semana. Número de ciclos promedio tres con
buenos resultados.
Drogas alternativas
Rifampicina, 600 mg/día,
vía oral, por 3 a 4 semanas
Dapsona, 3 mg/kg de peso/día,
vía oral, por 3 a 4 semanas
Ketoconazol, 600 mg/día,
vía oral, por 4 semanas
LEISHMANIASIS
MUCOCUTÁNEA O ESPUNDIA
Droga de
elección
Antimoniales pentavalentes (antimoniato
de N- metilglucamina, estibogluconato de sodio), a la dosis de 20
a 50 mg/kg de peso/día, IV o IM, por 30 días,
aplicación diaria.
Droga alternativa
Anfotericina B, a la dosis de 0,5 a 1,0
mg/kg de peso/día IV diluido en 500 mL de dextrosa al 5%,
hasta un máximo de 50 mg/día y alcanzar la dosis
acumulada de 2,5 a 3 g.
LEISHMANIASIS
VISCERAL
Antimoniales pentavalentes (antimoniato
de N- metilglucamina, estibogluconato de sodio), a la dosis de 20
mg Sb/kg de peso/día, IM o IV, por 30 días,
aplicación diaria.
Antimoniales
Los antimoniales, desarrollados en 1940,
continúan siendo las drogas de
elección para el tratamiento de las leishmaniasis. Existen
dos sales de antimonio pentavalentes disponibles: el antimoniato
de N-metilglucamina y el estibogluconato de sodio. Ambas drogas
son similares en eficacia y toxicidad. Sus mecanismos de
acción no son bien conocidos, aunque ellos pueden inhibir
la glicólisis y oxidación de los ácidos
grasos de la leishmania.
El antimoniato de N-metilglutcamina, es
utilizado en la mayoría de países de América
Latina y Francia. Es
una droga
hidrosoluble, se presenta en ampollas de 5 mL en solución
al 30% que contiene 1,5 g de sal antimonial bruta que corresponde
a 425 mg de antimonio. Existe controversias con la dosis y de los
intervalos de aplicación. Se recomienda usar dosis de 20
mg/kg/día. Es una sustancia de eliminación
rápida.
El estibogluconato de sodio, descubierto
por Schmidt en 1936, es un gluconato pentavalente de sodio y
antimonio, que contiene 30 a 34% de antimonio pentavalente. Es
considerada la droga de elección para el tratamiento de la
leishmaniasis cutánea, mucocutánea y visceral en
los países de habla inglesa, incluyendo los Estados Unidos.
Se presenta en ampollas de 2 mL/5 mL, que contienen 100 mg de
antimonio en 1 mL. La dosis empleada es de 20 mg de
antimonio/kg/día.
Entre los efectos adversos de los
antimoniales se incluyen debilidad, anorexia,
mialgias, artralgias, inapetencia, náuseas,
vómitos,
plenitud gástrica, epigastralgia, cefalea, mareos,
palpitaciones, prurito y cardiotoxicidad, especialmente asociada
a dosis altas y tiempo prolongado. Las alteraciones de
laboratorio incluyen leucopenia, trombocitopenia,
elevación de amilasas, lipasas y de transaminasas
hepáticas. El tratamiento debe ser monitorizado, pero la
mayoría de las alteraciones se normalizan
rápidamente al suspender el tratamiento. Las
contraindicaciones incluyen embarazo,
cardiopatías, nefropatías y
hepatopatías.
El antimoniato de meglumina
también se ha empleado en forma intralesional, con buenos
resultados en las formas cutáneas de leishmaniasis, lo que
hace que exista un menor riesgo de complicaciones.
Anfotericina B
Es un antibiótico
poliénico altamente lipofílico que actúa
sobre los esteroles y fosfolípidos de las membranas
celulares de las células; se emplea como droga de segunda
línea en el tratamiento de leishmaniasis resistente a los
antimoniales, especialmente en las formas mucocutánea y
diseminada difusa.
La anfotericina B se presenta en frascos
de 50 mg. Se comienza con 0,5 mg/kg/día y se aumenta
gradualmente hasta 1 mg/kg/día en días alternos,
sin sobrepasar la dosis de 50 mg por día. Se debe
administrar hasta la cura clínica, lo que debe ocurrir
cuando se llega a la dosis de 1 a 1,5 g en la forma
cutánea y de 2,5 a 3 g en las formas mucosas y
mucocutáneas. La anfotericina B se administra por
vía IV diluida en 500 mL de dextrosa al 5%. El paciente
debe estar en monitoreo clínico estricto,
acompañado de pruebas de laboratorio que permitan evaluar
la función renal, hepática, hematológica y
cardiaca. Se excreta por vía renal.
Los efectos secundarios son variados,
principalmente a nivel renal, anemia y convulsiones. Se presentan
frecuentemente fiebre, anorexia, náuseas, vómitos y
flebitis. La anfotericina B produce una hipopotasemia importante
que puede agravar y contribuir al desarrollo de insuficiencia
cardiaca.
La anfotericina liposomal es menos
tóxica que la anfotericina B. Los transportadores
liposomales de drogas son ideales para el tratamiento de la
leishmaniasis, porque las leishmanias viven dentro de los
macrófagos. La anfotericina está contraindicada en
gestantes, cardiopatías, neuropatías y
hepatopatías.
Pentamicina
Es una diamidina con un amplio espectro
de actividad antiparasitaria. Efectiva contra la leishmaniasis,
tripanosomiasis y pneumocistosis. En la leishmaniasis
actúa inhibiendo la replicación del cinetoplasto.
Tiene alta afinidad por las proteínas titulares, se
acumula en el hígado, riñones, glándulas
suprarrenales y bazo. Se elimina por vía renal lentamente,
hasta días después de finalizado el
tratamiento.
La pentamicina es usada como un
medicamento alternativo en los casos que no responden a los
antimoniales pentavalentes. Se ha obtenido buenos resultados con
bajas dosis en la L. (V) guyanensis. La dosis recomendada es de 4
mg/kg/día, vía intramuscular profunda de 2 / 2
días. La duración del tratamiento varía de 5
a más semanas, de acuerdo con la respuesta clínica.
Se presentan en frasco ampolla de 300 mg, bajo la forma de dos
sales: el mesilato y el isetionato. Se prefiere el isetionato por
tener menos efectos colaterales.
Las reacciones adversas más
frecuentes son dolor, induración y abscesos
estériles en el sitio de aplicación, además
de náuseas, vómitos, mareos, adinamia, mialgia,
cefalea, hipotensión, lipotimias, síncope,
hiperglicemia e hipoglicemia. Debe ser administrado
después de los alimentos, por su acción
hipoglicemiante. Se recomienda, durante el tratamiento, realizar
exámenes de laboratorio de funciones renal y
hepática, glicemia y ECG. Contraindicaciones: gestantes,
diabetes,
insuficiencia
renal, insuficiencia hepática y enfermedades
cardiacas.
Aminosidina
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
